WRN 抑制剂怎么高效合成?ChemAIRS 给出三条路线
WRN 是维持基因组稳定的多功能 DNA 解旋酶,尤其擅长修复(TA)n 片段形成的特殊十字形结构。WRN 抑制剂会致使复制叉停留在(TA)n 片段处,从而造成大量的 DNA 复制中间体和 DNA 双链损伤的聚集,最终会引发染色体碎片化,诱导细胞死亡。
WRN 基因与 MSI-H 存在紧密的合成致死关系,因此,MSI-H/dMMR 的肿瘤对 WRN 抑制剂敏感。2024 年,首个 WRN 临床化合物 34(HRO761)在《自然》发表,其 IC50 达 100 nM、GI50 低至 40 nM,兼具优良理化性质和药代动力学特征,更实现了无 DNA 竞争的特异性抑制,为肿瘤治疗带来新希望。
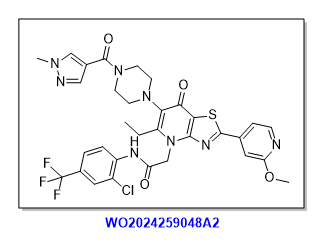
ChemAIRS 的创新路线
尽管 WRN 抑制剂前景广阔,但复杂的分子结构给合成带来巨大挑战。ChemAIRS 基于大数据挖掘、深度学习模型,针对目标化合物及类似结构,设计了差异化的合成路线。
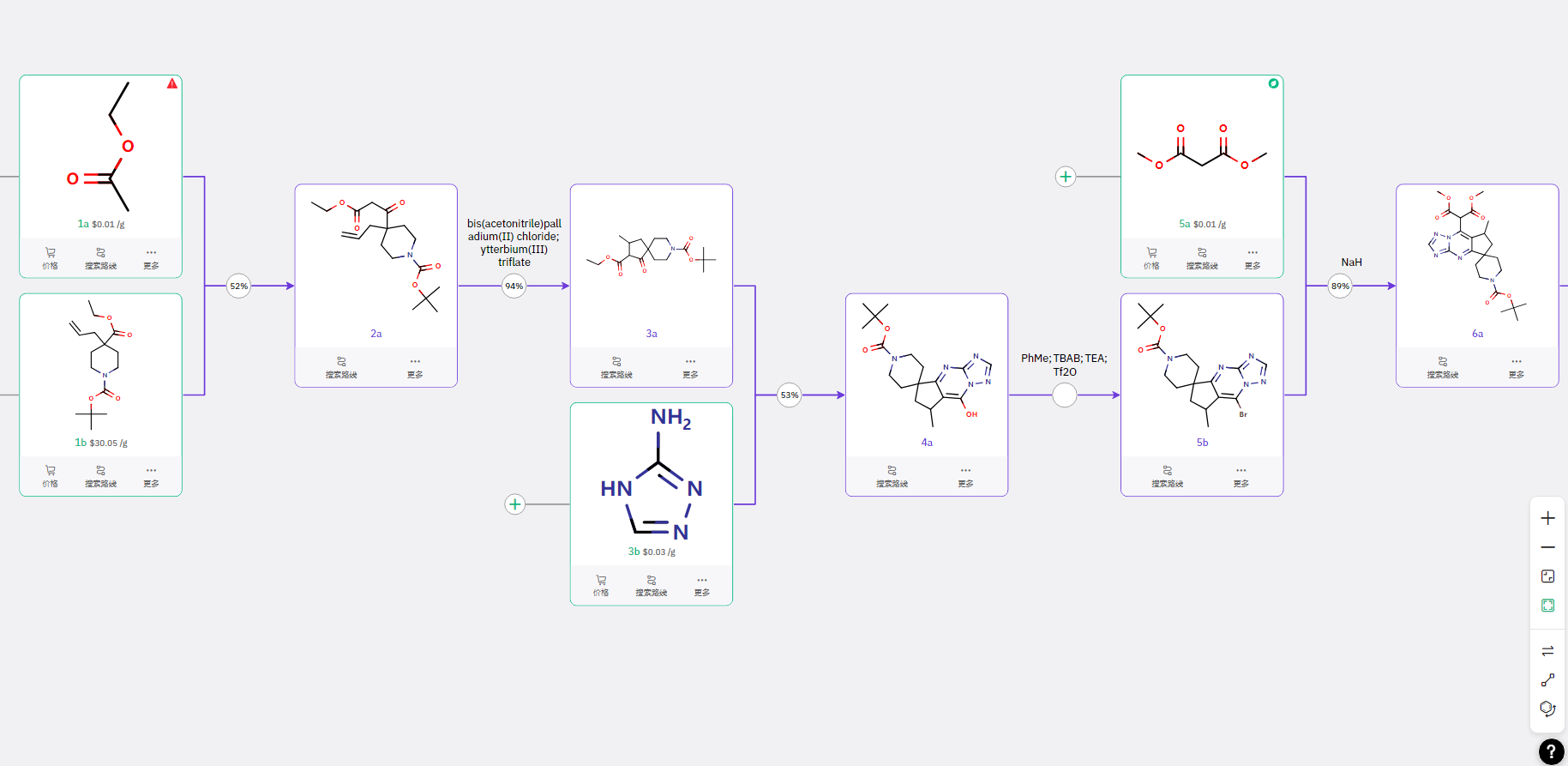
路线一
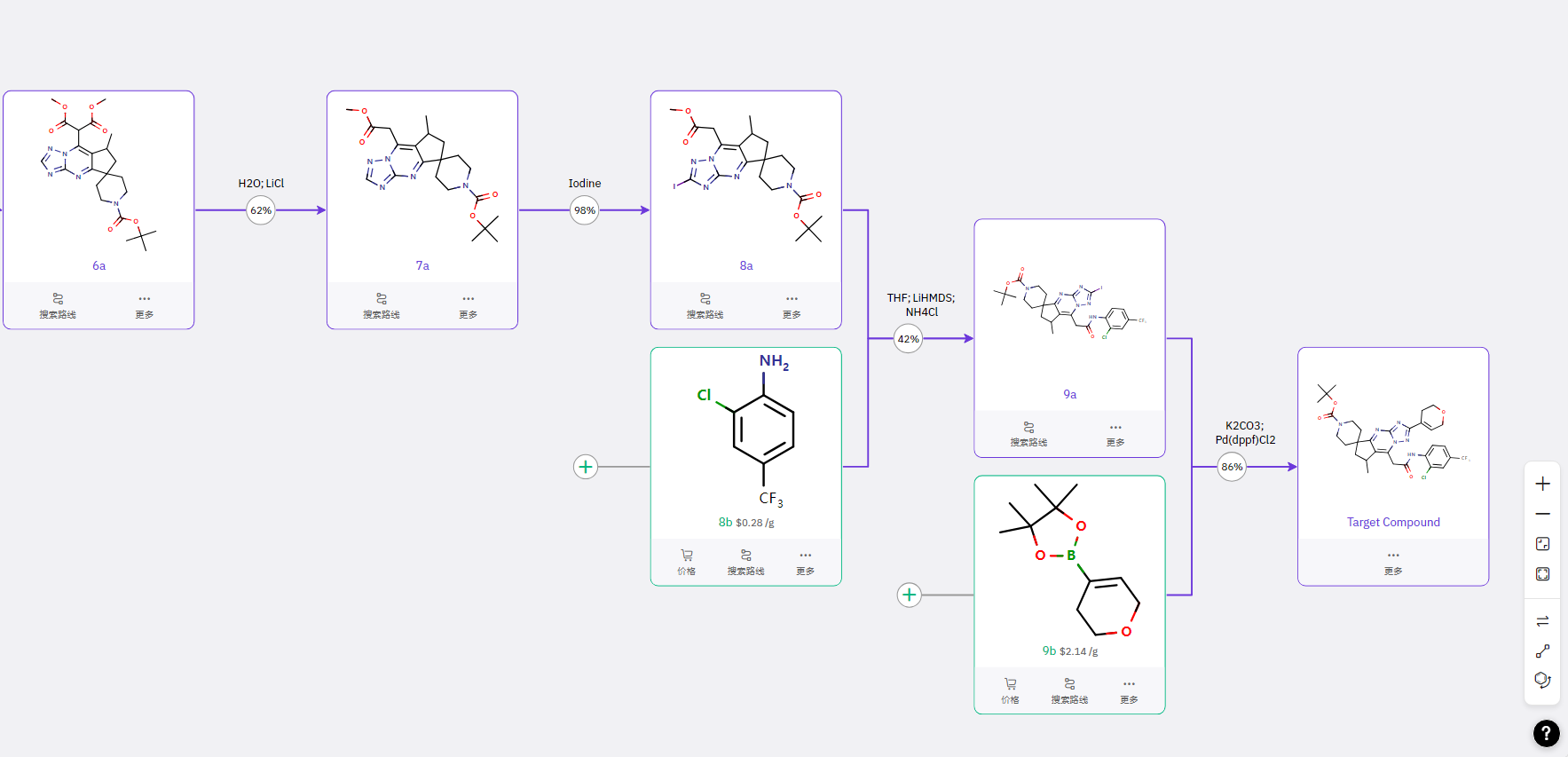
通过参考已知文献合成的化合物 3a 与由醛与氰胺反应的中间体合成噻唑衍生物 4a,经关环得到核心单元结构 5b,再通过氯乙酸甲酯反应、溴代等步骤得到 9b;同时,参考已知文献合成中间体 9a,进行取代反应得到 10b,最后完成胺酯交换得到目标产物。
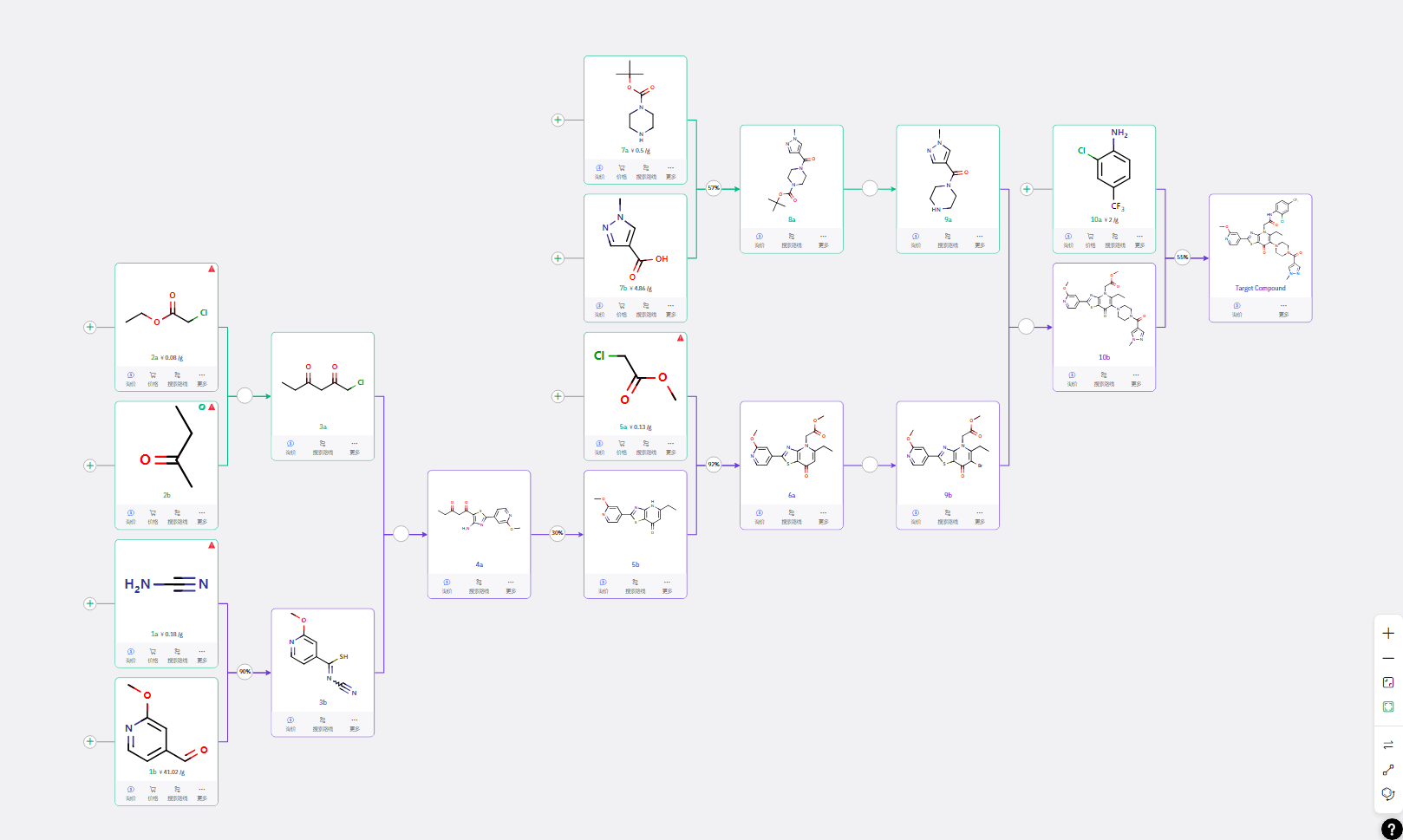
路线二
以 Suzuki 偶联反应得到 2a,经酰氯制备、丙炔反应得到酮衍生物 4b,再与胺基甲酸酯反应完成关环与得到关键中间体 5a,通过溴代制备中间体 8a;后续步骤与路线一类似。最关键的差异是中间体 5a 的路线设计。
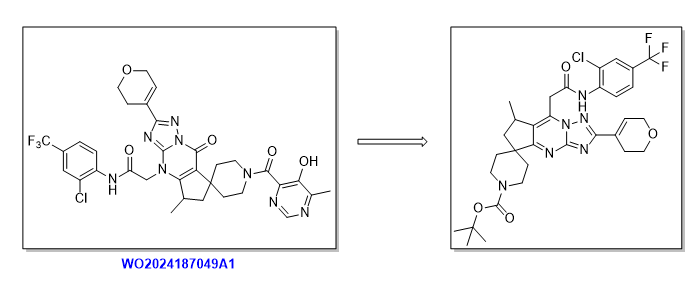
应对结构差异的“定制方案”
专利 WO2024187049 中报道了类似活性的化合物,单分子结构的细微差异有时候需要完全不同的设计策略。基于该分子的结构,给出了右侧潜在中间体的结构。
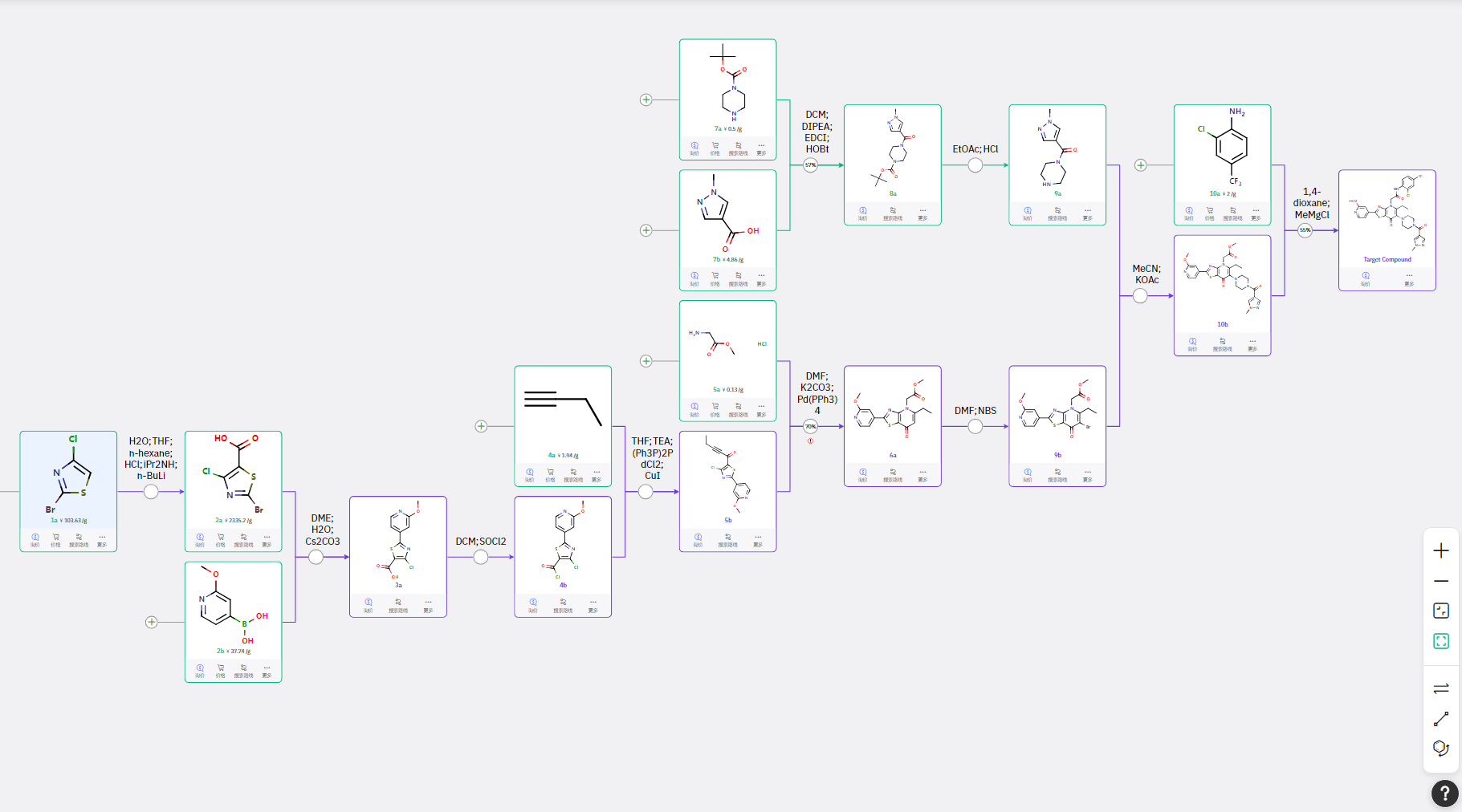
ChemAIRS 给出的路线
通过 Claisen 缩合、分子内关环构建核心结构 4a,在中性条件下完成溴代、碳链引入,最终经 胺酯交换、Suzuki 偶联,完成目标产物合成。ChemAIRS 基于分子的结构差异,提供了合理可行的执行路线。
从首个 WRN 抑制剂的临床突破,到 AI 设计的多条高效合成路线,药物研发正从 “经验驱动” 向 “数据智能驱动” 跨越。
ChemAIRS的出现,正将化学家从繁重的路线试错中解放出来,通过提供多方案、可定制、数据驱动的智能逆合成设计,显著加速了从分子蓝图到现实药物的进程。
参考文献
J. Med. Chem. 2025, 68, 13218−13245





