靶向 IBD 治疗:口服 α4β7 抑制剂的合成创新
炎症性肠病(IBD),包括克罗恩病和溃疡性结肠炎,是一类由免疫系统异常攻击肠道组织引发的慢性疾病。其中,整合素 α4β7 与 MAdCAM-1 的相互作用,被认为是白细胞向肠道迁移的关键通路,也成为 IBD 治疗的重要靶点。
已有生物制剂如维多珠单抗(ENTYVIO®)上市,但其注射给药方式限制了患者的用药便利性。开发一种口服小分子抑制剂,成为全球科研团队竞相追逐的方向。
小分子抑制剂的研发挑战
尽管目标明确,但开发高选择性、强活性且具备良好口服生物利用度的 α4β7 小分子抑制剂仍面临多重挑战。
近年来,包括 PN-943(Protagonist Therapeutics)、MORF-057(Eli Lilly)在内的多个候选药物在临床研究中遭遇波折,也反映出这一领域的高难度。
Morphic Therapeutic, Inc. 的 MORF-057 作为 α4β7 整合素小分子抑制剂,目前处于 2 期临床阶段,口服给药的特性使其备受关注。
在最近的美国化学学会(ACS)秋季年会上,吉利德(Gilead Sciences)首次披露了 GS-1427,一种口服 α4β7 抑制剂,具有皮摩尔水平活性和高选择性,已进入 2 期临床试验。
ChemAIRS 设计的四条合成路线
面对这类结构复杂的活性分子,ChemAIRS 基于大数据成功抓取到该活性化合物的专利文献报道路线,为目标分子设计出多条合成路线,覆盖快速制备与放大生产两种典型场景。
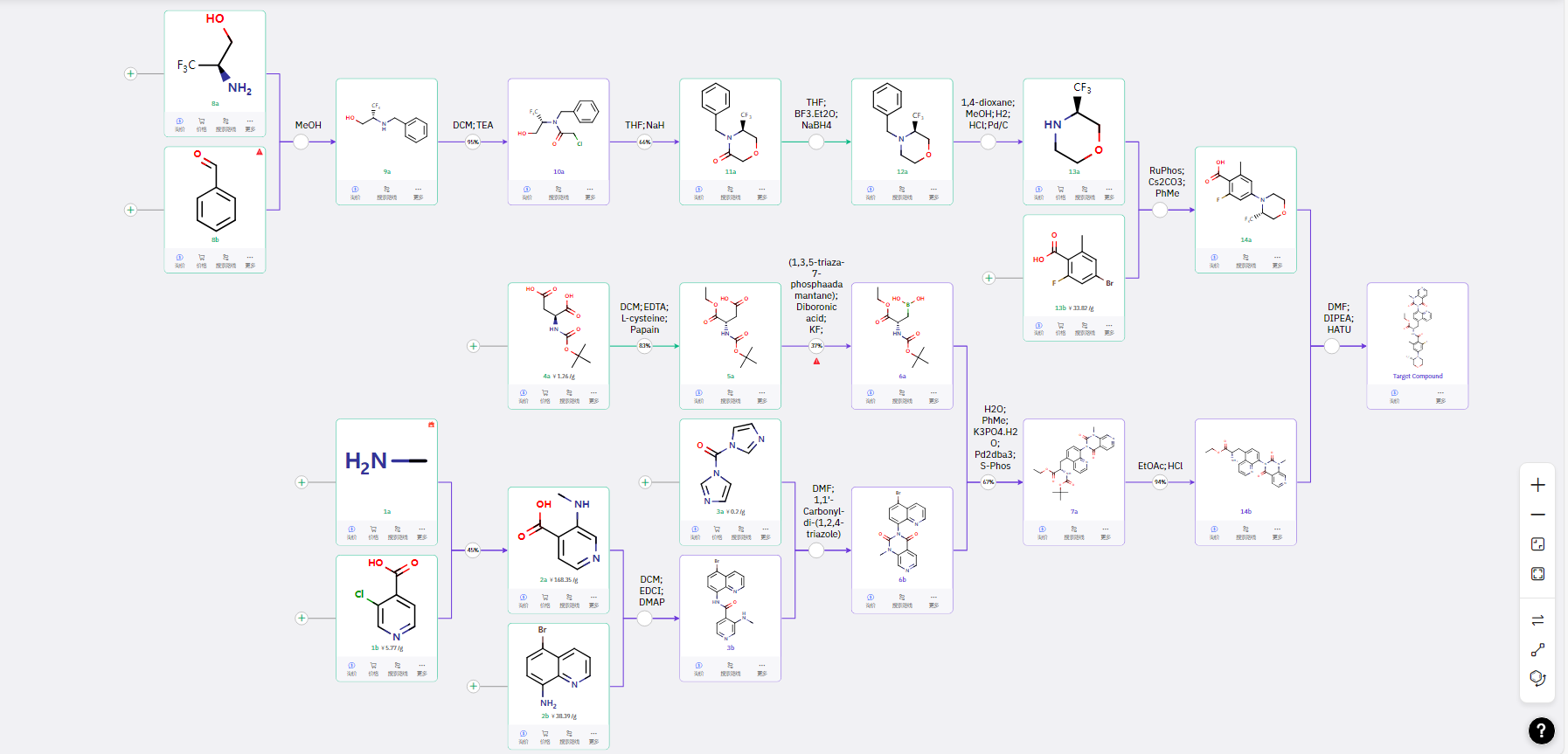
01 路线一:适合放大的手性传递路线
通过三氟甲基取代的手性小分子胺引入苄基保护,然后继续氯乙酰化及分子内的关环,还原及脱保护得到三氟甲基取代吗啡啉的单元结构,经与羧酸的缩合得到 14a。同时,以 3-氯代2-吡啶羧酸与甲胺的取代及2b 的缩合完成分子内的关环得到 6b,6b 与由羧酸 5a转化成的硼酸 6a 进行偶联引入手性氨基酸结构得到7a,脱保护后与 14a 进行缩合得到目标产物。
整个路线中的手性均来自于原料,后续反应中维有强酸强碱体系,适合进行放大制备。
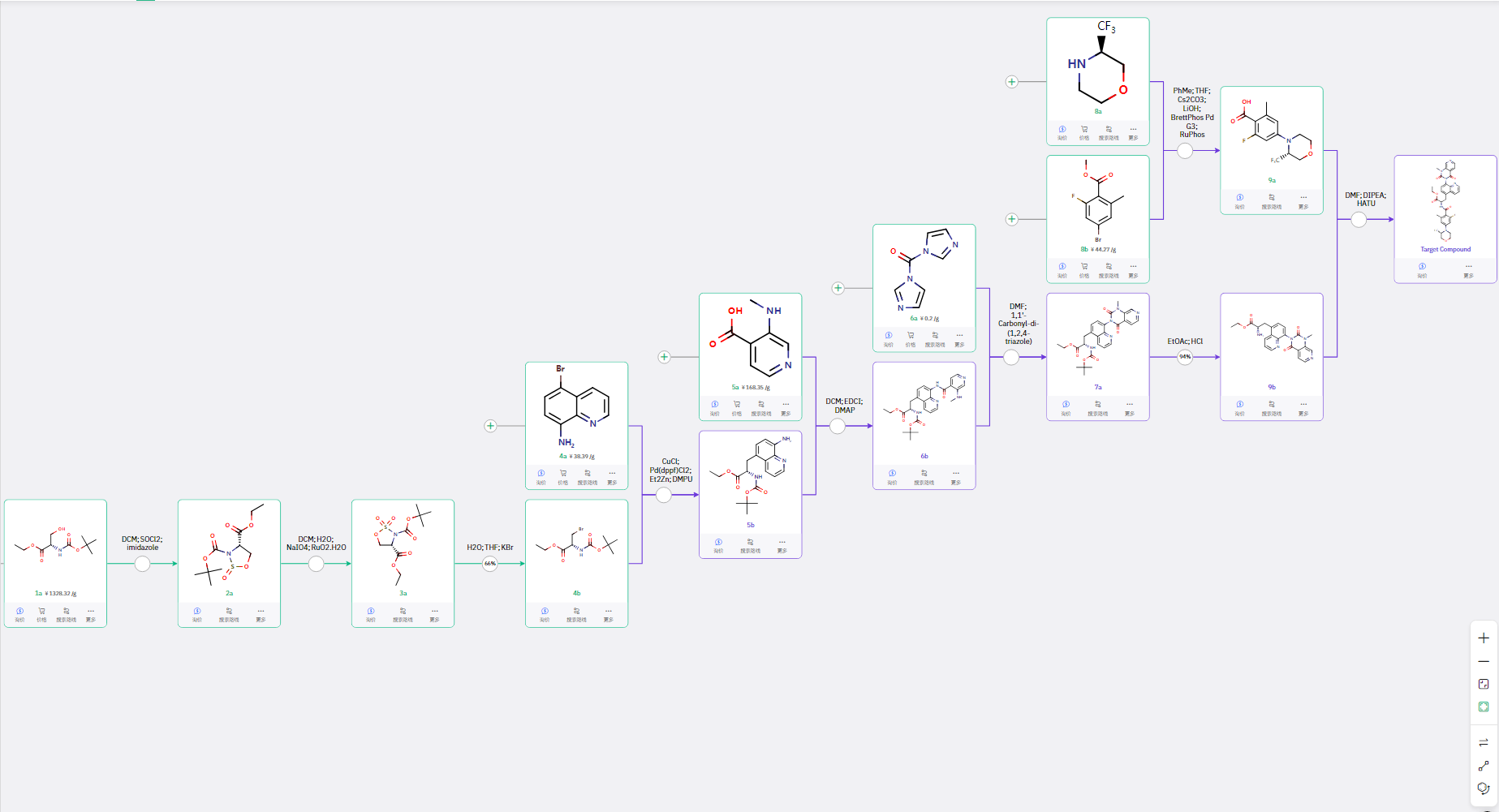
02 路线二:线性高效的小规模路线
依文献合成中间体 4b 后,4a 与现场制备的锌试剂偶联得到 5b,然后与羧酸 5a 进行酸胺缩合得到 6b,经分子内成脲,得到关环产物 7a,脱 Boc 保护得到 9b;8a 和 8b 经 C-N 偶联和水解得到 9a;9a 与 9b 进行酸胺缩合得到目标产物。
该路线是典型的线性路线,每步反应条件符合快速制备的路径,适合小规模快速制备目标化合物。
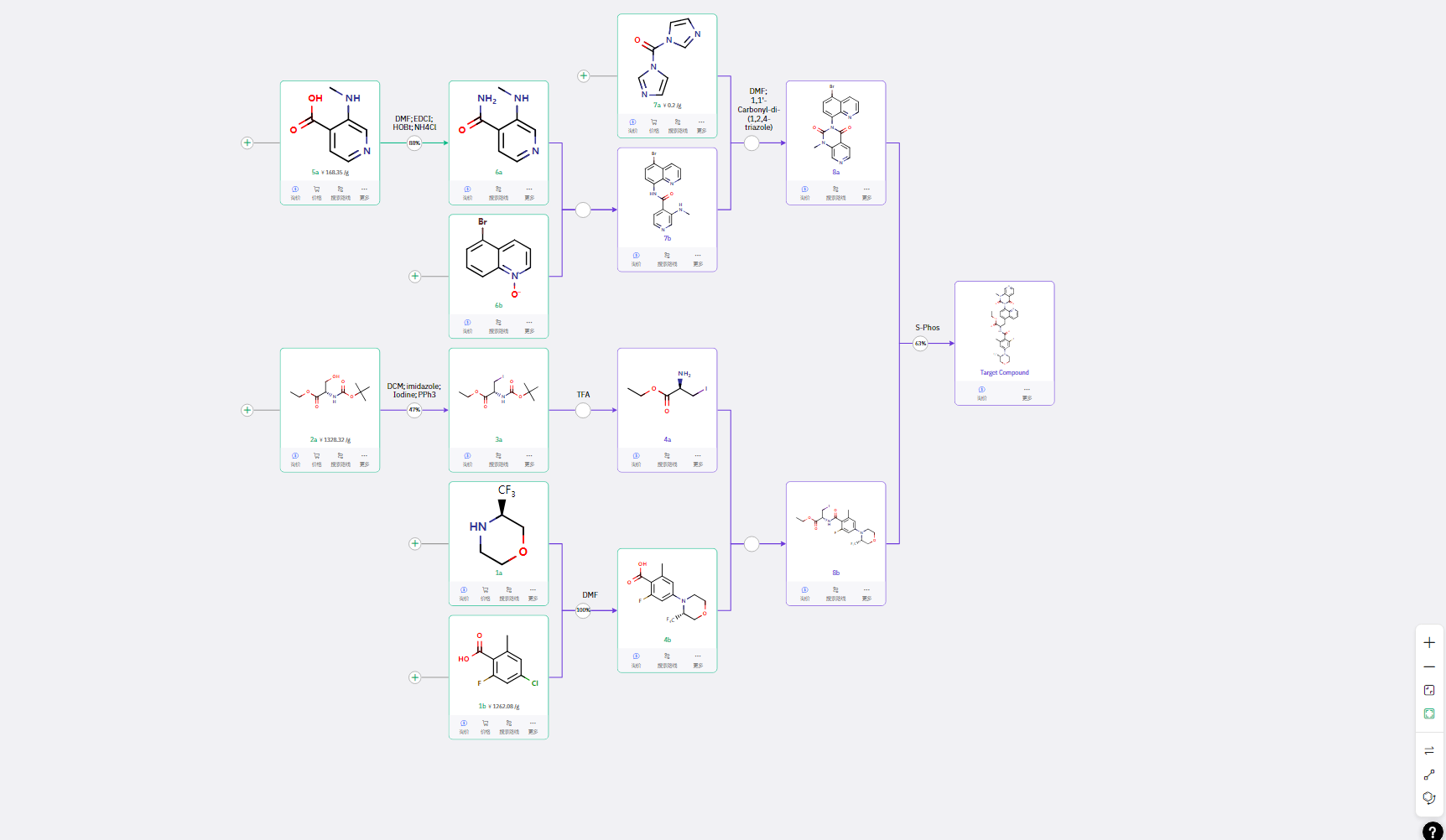
03 路线三:C-H 活化与成脲环化路线
1a 与 1b 完成分子间的偶联生成 4b;手性氨基酸原料经典代脱保护后生成 4a,4a 与 4b 进行酸胺缩合得到 8b;羧酸5a 成酰胺后与 6b 进行分子间的 C-H 键活化反应生成中间体 7b,分子内成脲生成关环中间体 8a。 8b 原味制备锌试剂然后与 8a 进行偶联得到目标产物。
04 路线四:不对称氢化规避专利
3b 通过前面类似的路线进行合成,然后与 3a 完成分子间的 Heck 反应得到中间体 5b;4a 与 4b 进行分子间的 C-N偶联后,再与 5b 进行酰胺以烯基卤素的 C-N 键构建;最后通过不对称氢化完成手性氨基酸的构建得到目标产物。
该路线包含手性合成策略,是规避专利路线的一种新路线。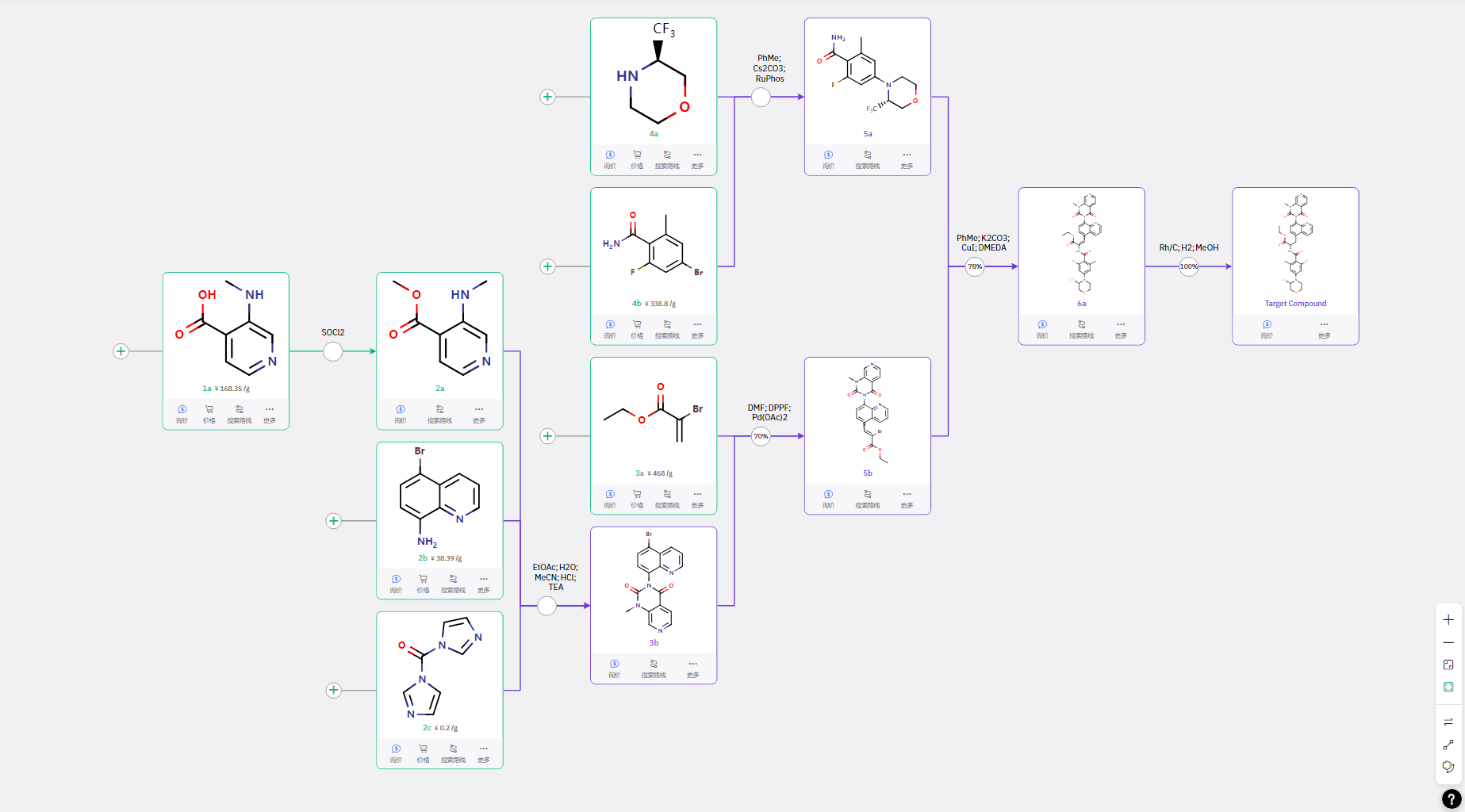
四条合成路线展示了 ChemAIRS 从最简单易得的原料通过完整的路线,遵循合理的反应步骤的先后顺序,官能团的兼容等内在逻辑最终合成目标产物的过程。用户可以通观全局也可以通过设置或调整中间体为原料以减少合成步骤,规划项目安排,缩短合成周期。在药物分子结构日益复杂的今天,AI 辅助路线合成不仅加速了候选化合物的发现,也为规避专利壁垒、优化工艺路线提供了全新可能。





